Hóa hữu cơ là một lĩnh vực trong ngành hóa học nghiên cứu về các hợp chất chứa cacbon. Trong bài viết này, chúng ta sẽ tìm hiểu về các khái niệm cơ bản liên quan đến hóa hữu cơ và hiđrocacbon.
1. Khái niệm hóa hữu cơ
Hợp chất hữu cơ là những hợp chất chứa cacbon (trừ các hợp chất đơn giản như CO, CO2, HCN, các muối cacbonat, muối xianua hay muối cacbua,…). Hóa học hữu cơ là ngành hóa học nghiên cứu về các hợp chất hữu cơ.
- Đặc điểm cấu tạo: Hợp chất hữu cơ bắt buộc phải chứa nguyên tử cacbon (C) trong thành phần của hợp chất. Các nguyên tử C liên kết với nhau và cũng liên kết với các nguyên tử khác, thường là với Hidro (H), sau đó đến Oxy (O), Nito (N), một số hợp chất chứa cả lưu huỳnh (S) và Photpho (P),…
- Liên kết hóa học trong các hợp chất hữu cơ chủ yếu là liên kết cộng hóa trị. Các phản ứng thường diễn ra chậm và không xảy ra hoàn toàn, không diễn ra theo một hướng nhất định. Số lượng các hợp chất hữu cơ lên đến khoảng 10 triệu chất, nhiều hơn hẳn so với số lượng các chất vô cơ chỉ có khoảng 100.000 chất.
- Tính chất vật lý: Các hợp chất hữu cơ dễ bay hơi, có nhiệt độ nóng chảy và sôi thấp hơn so với các hợp chất vô cơ. Hơn nữa, chúng kém bền với nhiệt độ và dễ cháy hơn so với các hợp chất vô cơ. Đa số các hợp chất hữu cơ không tan trong nước nhưng lại tan nhiều trong các dung môi hữu cơ.
- Tính chất hóa học: Hầu hết các phản ứng trong hóa hữu cơ diễn ra chậm và không xảy ra hoàn toàn, thường tạo ra hỗn hợp nhiều sản phẩm.
 Hợp chất hữu cơ - đại cương hóa hữu cơ
Hợp chất hữu cơ - đại cương hóa hữu cơ
2. Phân loại và gọi tên các hợp chất hữu cơ
2.1. Phân loại các hợp chất hữu cơ
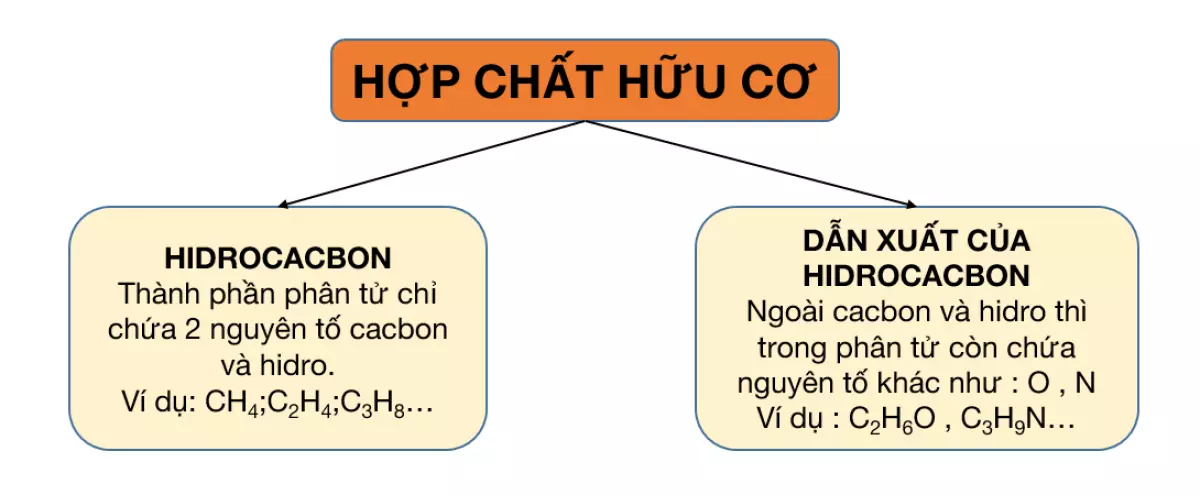
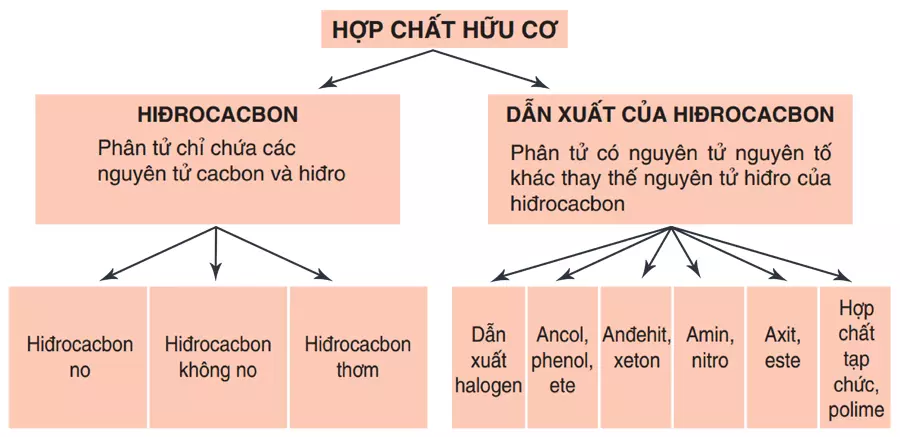
Hợp chất hữu cơ được phân thành 2 loại chính:
-
Hiđrocacbon: Trong phân tử chỉ chứa hai nguyên tố là C (cacbon) và H (hidro). Hiđrocacbon có thể chia thành các nhóm nhỏ như sau:
- Hiđrocacbon no: chỉ có các liên kết đơn (CH4, C2H6,…)
- Hiđrocacbon không no: có cả các liên kết đơn và liên kết đôi, liên kết ba (C2H4, C2H2,…)
- Hiđrocacbon thơm: có vòng benzen trong phân tử (C6H6, C7H8,…).
-
Dẫn xuất của hiđrocacbon: Trong phân tử ngoài nguyên tố C và H thì còn chứa các nguyên tố khác như O, N, Cl, S, P,…
- Dẫn xuất halogen: CH3Cl, C6H5Br,…
- Ancol: CH3OH, C2H5OH,…
- Axit: CH3COOH, ...
- Anđehit: HCHO, CH3CHO,…
- Phenol: C6H5OH,…
- Xeton: CH3COCH3,…
- Este: CH3COOC2H5,…
- Ete: CH3CH2OCH2CH3,…
 Phân loại hợp chất hữu cơ - lý thuyết hóa hữu cơ
Phân loại hợp chất hữu cơ - lý thuyết hóa hữu cơ
Phân loại theo dạng mạch cacbon:
-
Mạch hở: Các nguyên tử cacbon trong phân tử không được đóng thành vòng.
- Mạch thẳng: Cấu trúc mạch ở dạng thẳng.
- Mạch nhánh: Cấu trúc mạch có phân nhánh.
-
Mạch vòng: Các nguyên tử cacbon trong phân tử được đóng thành vòng khép kín.
- Đồng vòng: Các nguyên tử cacbon đóng vòng lại tạo thành vòng khép kín.
- Dị vòng: Vòng khép kín được tạo thành từ các nguyên tử cacbon và có sự tham gia của các nguyên tử của nguyên tố khác như O, N,…
2.2. Gọi tên các hợp chất hữu cơ (Danh pháp hữu cơ)
2.2.1. Tên gọi hệ thống theo danh pháp IUPAC
Tên gốc - chức: tên phần gốc + tên phần định chức 
Tên thay thế: tên phần thế + tên mạch C chính + tên phần định chức 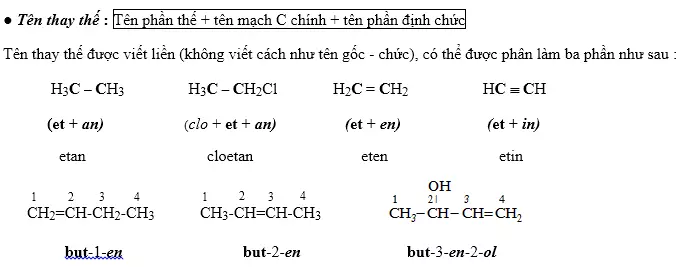
Để gọi tên một cách chính xác các hợp chất hữu cơ, chúng ta cần học thuộc các cách gọi tên các số đếm và tên mạch C chính.
Số đếm:
- 1: mono
- 2: di
- 3: tri
- 4: tetra
- 5: penta
- 6: hexa
- 7: hepta
- 8: octa
- 9: nona
- 10: deca
Tên mạch cacbon chính:
- Tên gốc = tên mạch cacbon + “yl” Ví dụ: CH3 - : metyl, C2H5 -: etyl
- Các gốc riêng: Ví dụ:
- CH2 = CH - : vinyl
- CH2 = CH - CH2 - : anlyl
2.2.2. Tên gọi thông thường
Tên thông thường của các hợp chất hữu cơ thường được đặt theo nguồn gốc tìm ra chúng, một số có thể có phần đuôi để chỉ rõ hợp chất thuộc loại nào. Ví dụ:
- HCOOH: axit fomic (formica ⇔ Kiến).
- CH3COOH: axit axetic (acetus ⇔ Giấm).
- C10H20O: mentol (mentha piperita ⇔ Bạc hà).
3. Công thức phân tử hợp chất hữu cơ
3.1. Công thức tổng quát (CTTQ)
Công thức tổng quát cho biết thông tin về các nguyên tố có trong phân tử hợp chất hữu cơ. Ví dụ: ứng với công thức tổng quát CxHyOzNt, ta biết hợp chất hữu cơ này được cấu tạo từ các nguyên tố C, H, O và N.
3.2. Công thức đơn giản nhất (CTĐGN)
3.2.1. Định nghĩa
Công thức đơn giản nhất là công thức thể hiện tỉ lệ tối giản về số nguyên tử của các nguyên tố trong phân tử.
3.2.2. Cách thiết lập công thức đơn giản nhất
Thiết lập công thức đơn giản nhất của HCHC CxHyOzNt nghĩa là thiết lập tỉ lệ:
- x : y : z : t = (mC/12) : (mH/1) : (mO/16) : (mN/14)
- x : y : z : t = (%mC/12) : (%mH/1) : (%mO/16) : (%mN/14)
3.2.3. Công thức thực nghiệm (CTTN)
Công thức thực nghiệm = (CTĐGN)n (trong đó n: số nguyên dương và CTĐGN: Công thức đơn giản nhất). Xác định n để tìm CTTN (công thức phân tử) của hợp chất hữu cơ.
3.3. Công thức phân tử
3.3.1. Định nghĩa
Công thức phân tử là công thức thể hiện số lượng nguyên tử của mỗi nguyên tố trong cấu trúc phân tử của nó.
3.3.2. Cách thiết lập công thức phân tử
Có ba cách để thiết lập công thức phân tử:
- Dựa vào thành phần % khối lượng của các nguyên tố: x = M.%mC/(12.100); y = M.%mH/(1.100); z = M.%mO/(16.100);
- Dựa vào CTĐGN (công thức đơn giản nhất): Sử dụng công thức k = (2x+2+t-y)/2 để tính độ bất bão hòa của phân tử và xác định CTPT (công thức phân tử).
- Tính trực tiếp theo khối lượng của sản phẩm cháy.
4. Phân tích nguyên tố trong hợp chất hữu cơ
4.1. Phân tích định tính
Mục đích: Xác định những nguyên tố có mặt trong thành phần hợp chất hữu cơ. Nguyên tắc: Chuyển các nguyên tố có mặt trong hợp chất hữu cơ thành các chất vô cơ đơn giản sau đó nhận biết chúng bằng các phản ứng đặc trưng.
4.2. Phân tích định lượng
Mục đích: Xác định thành phần % về khối lượng của các nguyên tố có mặt trong phân tử hợp chất hữu cơ. Nguyên tắc: Cân chính xác khối lượng của hợp chất hữu cơ. Sau đó chuyển nguyên tố C thành CO2, H thành H2O, N thành N2 rồi xác định chính xác khối lượng hoặc thể tích của các chất tạo thành. Từ đó tính được % khối lượng các nguyên tố.
5. Hiện tượng đồng đẳng và đồng phân
5.1. Đồng đẳng
Những hợp chất hữu cơ có thành phần phân tử hơn kém nhau một hay nhiều nhóm CH2 nhưng có tính chất hoá học tương tự nhau được gọi là những chất đồng đẳng với nhau, chúng hợp thành dãy đồng đẳng. Mặc dù các chất trong cùng dãy đồng đẳng có công thức phân tử (CTPT) khác nhau về số lượng nhóm CH2 nhưng do chúng có cấu tạo hoá học tương tự nhau nên có tính chất hoá học cũng tương tự nhau. Ví dụ: Các hiđrocacbon trong dãy: CH4, C2H6, C3H8, C4H10, C5H12,… CnH2n+2, chất phía sau hơn chất liền trước 1 nhóm CH2 và đều có tính chất hoá học tương tự nhau.
5.2. Đồng phân
Những hợp chất có cấu tạo khác nhau nhưng có chung công thức phân tử gọi là những chất đồng phân. Những chất đồng phân là những chất có cùng công thức phân tử nhưng có cấu tạo hoá học lại khác nhau, vì vậy chúng là những chất khác nhau, có tính chất khác nhau. Ví dụ: Etanol (C2H5OH) và đimetyl ete (CH3OCH3) là 2 chất hoàn toàn khác nhau (tính chất khác nhau) nhưng lại có chung công thức phân tử là C2H6O.

















